Anilina
L'anilina viene ampiamente utilizzata nell'ambito industriale e in quello da laboratorio, in quanto è particolarmente versatile e rappresenta la sostanza intermedia nella produzione industriali di numerosi farmaci e coloranti.
Cos'è?
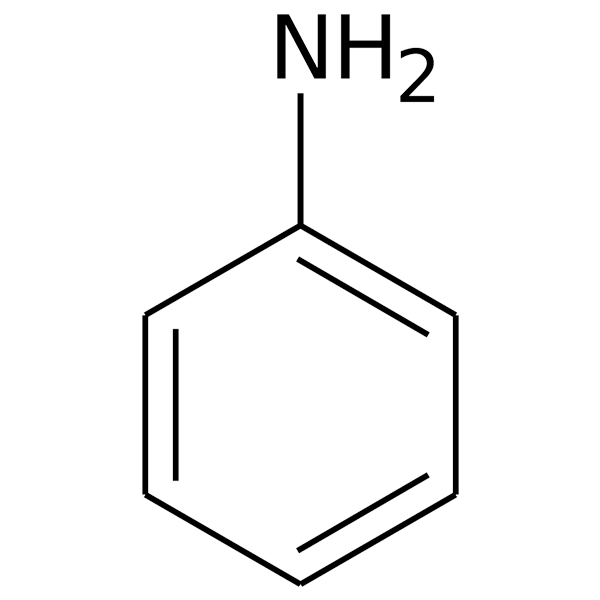
L'anilina è un composto aromatico di formula bruta C6H7N, altresì noto come fenilammina, benzenammina oppure amminobenzene. È classificato come un'ammina primaria la cui struttura è molto simile a quella del benzene, con la sola differenza relativa alla presenza di un gruppo NH2 al posto di un atomo H. A 21°C l'anilina è un liquido incolore. Questa sostanza tende a ossidarsi velocemente non appena viene messa a contatto con l'aria. Per questo viene conservata in alcuni contenitori ermetici. L'ossidazione dell'anilina provoca il mutamento del colore della stessa verso delle tonalità più oscure e con il tempo diventerà completamente nera.
Excursus storico
Per la prima volta in assoluto l'anilina venne isolata nel 1826 da Otto Unverdorben tramite il processo di distillazione. Per via del suo aspetto puro, all'inizio l'anilina ebbe il nome di "cristallina". Successivamente, nel 1834 F. Runge la isolò dal catrame osservando la colorazione blu dopo l'aggiunta della calce; egli chiamò questa sostanza "cianolo". Pochi anni dopo fu il turno di C. J. Fritzsche che ottenne l'anilina unendo l'indaco con la potassa caustica. Proprio lui la chiamò anilina (la radice "anil" deriva dalla lingua sanscrita "nīla" e significa blu scuro e pianta dell'indaco). Nello stesso anno il chimico russo N. N. Zinin ottenne l'anilina per riduzione del nitrobenzene e la chiamò benzidam. Solo nel 1855 A. W. von Hofmann dimostrò che tutte le sostanze ottenute sono, in realtà, un'unica sostanza ed egli la chiamò anilina oppure fenilammina.
Sintesi
Questa sostanza può essere facilmente ottenuta dal benzene in soli due passaggi.
Nitrazione del benzene
1) In primis bisogna eseguire la nitrazione del benzene. Si fa reagire il benzene con una miscela di acido solforico e di acido nitrico, entrambi concentrati, in modo da provocare una relazione di sostituzione elettrofila su di uno degli atomi d'idrogeno. Un atomo d'idrogeno si distaccherà.
Reazione del nitrobenzene con altre sostanze
2) Quindi occorre far reagire il nitrobenzene con alcune sostanze riducenti, tra di cui l'idrogeno con un catalizzatore oppure con un metallo (stagno, zinco o ferro) in presenza di un acido.
Anche alcuni derivati dell'anilina vengono sintetizzati nello stesso modo.
Reattività chimica
L'anilina è velenosa e provoca numerosi danni all'organismo se inalata o ingerita. Si può bruciare facilmente con la fiamma grande. Chimicamente si tratta di una base debole, seppure questa sua caratteristica è meno accentuata delle sostanze appartenenti al gruppo delle ammine alifatiche. L'anilina è in grado di reagire con gli acidi forti danno i sali di anilino (C6H5-NH3+). Inoltre interagisce con gli alogenuri acilici per dare le ammidi, che vengono chiamate anilidi. Reagendo con gli ioduri alchilici, l'anilina da vita alle ammine terziarie e secondarie; venendo bollita con il solfuro di carbonio, invece, forma la solfocarbalidie. L'anilina è una delle sostanze che subiscono molte reazioni di sostituzione elettrofila in posizione -orto e -para sull'anello aromatico. Per questo reagendo con l'acido solforico alla temperatura di 180° forma l'acido solfanilico. Sia l'anilina che i suoi derivati reagiscono con l'acido nitroso per formare i sali di diazonio. Con l'acroleina, invece, interagisce seguendo la sintesi di Skraup:
O=CH-CH=CH2 + C6H5-NH2 → C6H5-NH-CH2-CH=O
Utilizzi
L'anilina viene ampiamente utilizzata nell'ambito industriale e in quello da laboratorio, in quanto è particolarmente versatile e rappresenta la sostanza intermedia nella produzione industriali di numerosi farmaci e coloranti.
Il suo valore commerciale è legato proprio a questa sua caratteristica. Inoltre viene impiegata nella produzione di una vasta gamma di sostanze coloranti, come l'indaco, la fucsina, la safranina e molte altre. Negli anni '40 e '50 del XX secolo, inoltre, venne usata insieme all'acido nitrico o al tetraossido di diazoto in qualità di carburante per i missili.
Link utili:
Anilina



